TEORÍA SOBRE LA NATURALEZA DEL CALOR
Representa la cantidad de energía que un cuerpo transfiere a otro como
consecuencia de una diferencia de temperatura entre ambos. El tipo de energía
que se pone en juego en los fenómenos caloríficos se denomina energía térmica.
El carácter energético del calor lleva consigo la posibilidad de transformarlo
en trabajo mecánico. Sin embargo, la naturaleza impone ciertas limitaciones a
este tipo de conversión, lo cual hace que sólo una fracción del calor
disponible sea aprovechable en forma de trabajo útil.
Las ideas acerca de la naturaleza del calor han variado apreciablemente
en los dos últimos siglos. La teoría del calórico o fluido tenue que situado en
los poros o intersticios de la materia pasaba de los cuerpos calientes en los
que supuestamente se hallaba en mayor cantidad a los cuerpos fríos, había
ocupado un lugar destacado en la Física desde la época de los filósofos
griegos. Sin embargo, y habiendo alcanzado a finales del siglo XVIII su pleno
apogeo, fue perdiendo credibilidad al no poder explicar los resultados de los
experimentos que científicos tales como Benjamín Thomson (1753-1814) o Humphrey
Davy (1778-1829) realizaron.
Una vieja idea tímidamente aceptada por sabios del siglo XVII como
Galileo Galilei o Robert Boyle resurgió de nuevo. El propio Thompson , según
sus propias palabras, aceptó la vuelta a aquellas «viejas doctrinas que
sostienen que el calor no es otra cosa que un movimiento vibratorio de las
partículas del cuerpo».
Las experiencias de Joule (1818-1889) y Mayer (1814-1878) sobre la
conservación de la energía, apuntaban hacia el calor como una forma más de
energía. El calor no sólo era capaz de aumentar la temperatura o modificar el
estado físico de los cuerpos, sino que además podía moverlos y realizar un
trabajo.
Las máquinas de vapor que tan espectacular desarrollo tuvieron a finales
del siglo XVIII y comienzos del XIX eran buenos muestra de ello. Desde entonces
las nociones de calor y energía quedaron unidas y el progreso de la Física
permitió, a mediados del siglo pasado, encontrar una explicación detallada para
la naturaleza de esa nueva forma de energía, que se pone de manifiesto en los
fenómenos caloríficos.
Una unidad muy empleada para medir esta energía (el calor) es la
caloría: calor necesario para que 1 g. de agua
aumente 1ºC su temperatura.
No todos los cuerpos se calientan de la misma forma. El calor específico es la propiedad de los cuerpos que mide esa diferencia y se puede definir como el calor necesario para que la unidad de masa de un cuerpo aumente 1ºC su temperatura
No todos los cuerpos se calientan de la misma forma. El calor específico es la propiedad de los cuerpos que mide esa diferencia y se puede definir como el calor necesario para que la unidad de masa de un cuerpo aumente 1ºC su temperatura
DIFERENCIA ENTRE CALOR Y TEMPERATURA
Todos sabemos que cuando
calentamos un objeto su temperatura aumenta. A menudo pensamos que calor y
temperatura son lo mismo. Sin embargo, esto no es así. El calor y la temperatura
están relacionadas entre sí, pero son conceptos diferentes.
Como ya dijimos, el
calor es la energía total del movimiento molecular en un cuerpo, mientras que
la temperatura es la medida de dicha energía. El calor depende de la velocidad
de las partículas, de su número, de su tamaño y de su tipo. La temperatura no
depende del tamaño, ni del número ni del tipo.
Por ejemplo, si hacemos
hervir agua en dos recipientes de diferente tamaño, la temperatura alcanzada es
la misma para los dos, 100° C, pero el que tiene más agua posee mayor cantidad
de calor.
|
|
El calor es lo que hace
que la temperatura aumente o disminuya. Si añadimos calor, la temperatura
aumenta. Si quitamos calor, la temperatura disminuye.
La temperatura no es
energía sino una medida de ella; sin embargo, el calor sí es energía.
Cambios de estado
En la naturaleza existen
tres estados usuales de la materia: sólido, líquido y gaseoso. Al aplicarle
calor a una sustancia, esta puede cambiar de un estado a otro. A estos procesos
se les conoce como Cambios de estado. Los posibles cambios de estado son:
-de estado solidó a
liquido, llamado fusión.
-de estado liquido a
solidó, llamado solidificación.
-de estado liquido a
gaseoso, llamado vaporización
-de estado gaseoso a
liquido, llamado condensación
-de estado solidó a
gaseoso, llamado sublimación progresiva.
-de estado gaseoso a
sólido, llamado sublimación regresiva.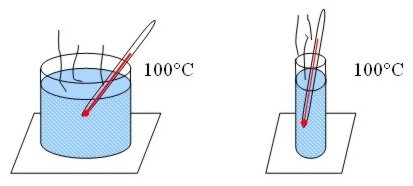

DILATACIÓN
Se denomina dilatación térmica al aumento de longitud, volumen o
alguna otra dimensión métrica que sufre un cuerpo físico debido al cambio de temperatura que
se provoca en ella por cualquier medio.
De una forma
general, cuando aumentamos la temperatura de un cuerpo (sólido o líquido),
aumentamos la agitación de las partículas que forman ese cuerpo. Esto causa un
alejamiento entre las partículas, resultando en un aumento en las dimensiones
del cuerpo (dilatación térmica). Por otra parte, una disminución en la
temperatura de un cuerpo, acarrea una reducción en sus dimensiones
(construcción térmica)
En la
construcción civil, por ejemplo, para prevenir posibles trincas y rupturas por
causa de dilatación térmica de los materiales, se utilizan “folgas” llamadas
como juntas de dilatación.
DILATACIÓN LINEAL
Más allá que la dilatación de un sólido suceda en todas las dimensiones,
puede predominar la dilatación de apenas una de sus dimensiones sobre las
demás. O aún, podemos estar interesados en una única dimensión del sólido. En
este caso, tenemos la dilatación lineal (DL).
El coeficiente de dilatación lineal, designado por αL, para una dimensión lineal cualquiera, se puede
medir experimentalmente comparando el valor de dicha magnitud antes y después
de cierto cambio de temperatura como:¿COMO?
Donde ΔL, es el incremento de su integridad física cuando se
aplica un pequeño cambio global y uniforme de temperatura ΔT a todo el cuerpo. El cambio total de longitud de
la dimensión lineal que se considere, puede despejarse de la ecuación anterior:
Donde:
α=coeficiente de dilatación lineal [°C-1]
L0 = Longitud inicial
Lf = Longitud final
T0 = Temperatura inicial.
Tf = Temperatura final
DILATACIÓN SUPERFICIAL
Ahora en un sólido, cuando las dimensiones predominantes son el
largo y el ancho sobre el espesor o altura, como ser una chapa o una lámina, al
exponerse a la acción del calor habrá un incremento o variación en la
superficie (ΔS) y no así en el espesor llamada dilatación superficial. Para
calcular la superficie final (Sf) de un sólido plano, la fórmula será:
Sf = Si .(1
+ β . ΔT)
El coeficiente de dilatación superficial ( β )
resultará de ser el doble del valor del coeficiente de dilatación lineal (α)
para cada una de las sustancias, porque al tratarse de dos dimensiones largo y
ancho, el cálculo es:
β = 2 . α
DILATACIÓN CÚBICA
En los sólidos, cuando predominan sus tres dimensiones como el
largo, ancho y altura, siendo un prisma, una esfera, un cubo, etc, al exponerse
a la acción del calor habrá un incremento o variación en el volumen (ΔV) se
denomina dilatación cúbica o volumétrica. Para calcular el volumen final (Vf)
en un sólido la fórmula será:
Vf = Vi .(1
+ γ . ΔT)
El coeficiente de dilatación cúbica ( γ )
resulta al ser el triple del valor del coeficiente de dilatación lineal (α)
para cada una de las sustancias, porque al tratarse de tres dimensiones largo,
ancho y altura, el cálculo es:
γ = 3 . α
DILATACIÓN
DE LÍQUIDOS
El efecto de la dilatación en los líquidos es más evidente que en los sólidos: al
encontrarse sus moléculas con más libertad para moverse, el volumen que ocupa
cada una aumenta más facilmente con la temperatura, por lo que también lo hace
el volumen del líquido en su conjunto. Su expresión es similar a la
dilatación volumétrica de los sólidos.
La dilatación de los líquidos sigue la expresión:
V=V0⋅(1+α⋅∆T)
Donde:
·
V, V0 : Volumen final e inicial respectivamente del
líquido. Su unidad de medida en el Sistema Internacional es el metro al cubo
( m3 )
·
α: Coeficiente
de dilatación del líquido. Es específico de cada líquido y
representa el aumento de volumen de un líquido de volumen la unidad, cuando su
temperatura se eleva 1 K. Su unidad de medida en
el Sistema Internacional es el K-1, aunque
también se usa el ºC-1
·
∆T: Incremento
de temperatura que
experimenta el líquido. Su unidad de medida en el Sistema Internacional es
el kelvin ( K ), aunque también se usa
el ºC
Observa que, aunque la unidad de temperatura en el Sistema
Internacional es el kelvin K, por comodidad también
se usa el grado centígrado ºC, en cuyo caso el
coeficiente de dilatación del líquido α se
expresa en ºC-1,
aunque su valor es el mismo.
Ten muy presente que cuando queremos medir la dilatación en
un líquido, hemos de tener en cuenta que el recipiente sólido en el que lo
colocamos también se
dilata.
CALORIMETRÍA
La Calorimetría es la parte de la física que se
encarga de medir la cantidad de calor generada en ciertos procesos físicos o
químicos.
El aparato que se encarga de medir esas cantidades es el calorímetro. Consta de un termómetro que esta en contacto con el medio que esta midiendo. En el cual se eencuentran las sustancias que dan y reciben calor. Las paredes deben estar lo más aisladas posible ya que hay que evitar al máximo elintercambio de calor con el exterior. De lo contrario las mediciones serían totalmente erróneas.
También hay una varilla como agitador para mezclar bien antes de comenzar a medir. Básicamente hay dos tipos de calorímetros. Los que trabajan a volúmen constante y los de presión constante.
El aparato que se encarga de medir esas cantidades es el calorímetro. Consta de un termómetro que esta en contacto con el medio que esta midiendo. En el cual se eencuentran las sustancias que dan y reciben calor. Las paredes deben estar lo más aisladas posible ya que hay que evitar al máximo elintercambio de calor con el exterior. De lo contrario las mediciones serían totalmente erróneas.
También hay una varilla como agitador para mezclar bien antes de comenzar a medir. Básicamente hay dos tipos de calorímetros. Los que trabajan a volúmen constante y los de presión constante.
La cantidad de calor que recibe
o transmite un cuerpo esta determinada por la siguiente fórmula:
Q
= m x Ce x (Tf – Ti)
Donde Q es el calor, m es la masa del cuerpo, Ce es el calor
específico del
cuerpo, que esta determinada por el material que lo compone. Y la vraiación de
temperatura se representa por la diferencia entre Tf y Ti (temperatura final e
inicial).
Cuando un cuerpo transmite el
calor hay otro que lo recibe. Este es el principio del calorímetro.
Ya que el termómetro determinara la temperatura final o
también llamada de equilibrio. El líquido más usado es el agua que actúa como
receptor de las calorías que transmite el cuerpo. El calor específico del agua
es de 1cal /grs °C. Cuando el agua hierve o se congela este valor cambia a
otros. Pero por ahora daremos ejemplos mientras este como agua líquida. Las
unidades pueden variar. A veces podemos ver otras unidades como J/grs°C donde J
es el joule en lugar de caloría. Ambas son unidades en las que se mide el
calor.
Por ejemplo, si introducimos un
trozo de cobre de 60 gramos a 100°C en 260 ml de agua a 18°C
y tenemos que determinar la temperatura final del equilibrio
podemos calcularla de la siguiente manera:
El calor que cede del cobre
será igual al calor que recibe el agua. Por lo tanto:
- Q Cu = + Q H2O
El signo menos se le coloca al
que desprende calor y el signo más al que absorve.
- masa Cu
x Cecu x (Tf – 100°C) = masa H2O x CeH2O x (Tf – 18°C)
-
60 grs
x (0,093 cal/°c.gr) x
(Tf – 100°C) = 260 grs x
(1 cal/°c.gr) x (Tf –
18°C)
Solo queda despejar la Tf.
-5.58 cal/°C x (Tf – 100°C) =
260 cal/°C x (Tf – 18°C)
Aplicamos la propiedad
distributiva:
-5.58 cal/°C Tf + 558 cal = 260
cal/°C Tf – 4680 cal
558
cal + 4680 cal = 260 cal/°C Tf + 5.58 cal/°C Tf
5238
cal = 265.58 cal/°C Tf
5238 cal / 265.18 cal/°C
= Tf
19.72°C = Tf
UNIDAD DE LA CANTIDAD DE CALOR
Caloría:
(cal) Es la cantidad de calor necesaria para elevar la temperatura de un gramo
de agua en un grado Celsius.
Kilogramo: (Kcal) Cantidad de calor necesaria para elevar la temperatura de un kilogramo de agua a un grado Celsius (1 Kcal=1000 cal).
Unidad Térmica Británica:(Btu) Es la cantidad de calor necesaria para elevar la temperatura de una libra patrón (Ib) de agua Fahrenheit.
Los resultados aceptados son:
1 Cal = 4.186 J
1 Kcal¨= 4186 J
1 Btu = 778 ft-Ib
Kilogramo: (Kcal) Cantidad de calor necesaria para elevar la temperatura de un kilogramo de agua a un grado Celsius (1 Kcal=1000 cal).
Unidad Térmica Británica:(Btu) Es la cantidad de calor necesaria para elevar la temperatura de una libra patrón (Ib) de agua Fahrenheit.
Los resultados aceptados son:
1 Cal = 4.186 J
1 Kcal¨= 4186 J
1 Btu = 778 ft-Ib
CALORES ESPECIFICOS
|
Sustancias
|
J/Kg. C°
|
Cal/g. C° O
|
|
|
|
Btu/Ib . F°
|
|
Acero
|
480
|
0.114
|
|
Agua
|
4186
|
1.00
|
|
Alcohol etílico
|
2500
|
0.60
|
|
Aluminio
|
920
|
0.22
|
|
Cobre
|
390
|
0.09
|
|
Hielo
|
2090
|
0.5
|
|
Hierro
|
470
|
0.11
|
|
Latón
|
390
|
0.09
|
|
Mercurio
|
140
|
0.03
|
|
Oro
|
130
|
0.3
|
|
Plata
|
230
|
0.056
|
|
Plomo
|
130
|
0.031
|
|
Termentina
|
1800
|
0.42
|
|
Vapor
|
2000
|
0.48
|
|
Vidrio
|
840
|
0.2
|
|
Zinc
|
390
|
0.09
|
PRINCIPIO DE LA
LA FISIÓN NUCLEAR es una reacción en la cual un núcleo pesado, al ser
bombardeado con neutrones, se convierte en inestable y se descompone en dos
núcleos, cuyos tamaños son del mismo orden de magnitud, con gran
desprendimiento de energía y la emisión de dos o tres neutrones.
Estos neutrones, a su vez, pueden ocasionar más fisiones
al interaccionar con nuevos núcleos fisionables que emitirán nuevos neutrones y
así sucesivamente. Este efecto multiplicador se conoce con el nombre de
reacción en cadena. En una pequeña fracción de segundo, el número de núcleos
que se han fisionado libera una energía un millón de veces mayor que la
obtenida al quemar un bloque de carbón o explotar un bloque de dinamita de la
misma masa.
Debido a la rapidez que tiene lugar una reacción nuclear,
la energía se desprende mucho más rápidamente que en una reacción química.
Si se logra que sólo uno de los neutrones liberados
produzca una fisión posterior, el número de fisiones que tienen lugar por
segundo es constante y la reacción está controlada. Este es el principio de
funcionamiento en el que está basado los reactores nucleares, que son fuentes
controlables de energía nuclear de fisión.
FUSIÓN FRÍA
En 1989 los profesores de química Stanley Pons y Martin Fleishmam informaron de que Habían logrado la fusión fría en un ánodo de paladio.Debido a la mala exactitud de su informe,solo unos pocos
científicos lograron imitar dicha fusión en un primer momento .
Finalmente la fusión fría se fue dejando y acabó convirtiendose
un tema tabú.
Sin
embargo, algunos científicos, con el tiempo, lograron los mismos resultados, y
pese a que no tuvieron mucha resonancia en la comunidad, se han publicaron
numerosos informes basados en experimentos de una calidad mas rigurosa y poco
a poco las teorías vuelven a ser aceptadas por la comunidad científica de una
forma más unánime.
Pese
a estos datos ,todavía no se entiende todo lo que ocurre en el proceso de fusión fría.La cantidad de calor, la radiación detectada ,similares a
la de la fusión convencional, hacen pensar que se produce algún
tipo de fusión.Pero las cantidades de radiación y la relación de productos que
se conocen de las reacciones de fusión caliente no se corresponden con la de
este tipo.Por lo que se suele utilizar el nombre de fusión
baja.
EL PROCESO DE FUSIÓN
FRÍA
Todavía
no existe un modelo totalmente desarrollado para la fusión fria. La hipótesis
detrás del fenómeno son simples: Todas las partículas se comportan de
acuerdo a las leyes de la mecánica cuántica.
Estas leyes dicen que las coordenadas y el estado de la energía en una
partícula en un punto en el tiempo determinan la probabilidad de encontrar una
partícula en un lugar con las coordenadas dadas en otro punto de tiempo,pese a
que el lugar exacto no se puede predecir.Por lo que algunos lugares son muy
probables y otros altamente improbables, pero no se puede saber con exactitud y
puede estar en cualquier lugar.
El comportamiento mecánico
cuántico cambia
su posición todo el tiempo y aveces las fuerzas nucleares reaccionan.
De acuerdo a la norma esto no peude ser detectado.Y si que lo hace, por lo que puede que la teoría estandar no este completa o no se a aprendido a usar de forma correcta.El aparato matemático es tan complicado que es imposible predecir lo que puede suceder sin haber estudiado y analizado rigurosamente las ecuaciones.
De acuerdo a la norma esto no peude ser detectado.Y si que lo hace, por lo que puede que la teoría estandar no este completa o no se a aprendido a usar de forma correcta.El aparato matemático es tan complicado que es imposible predecir lo que puede suceder sin haber estudiado y analizado rigurosamente las ecuaciones.
La fusión fría difiere en muchos aspectos de
la fusión caliente.Es dificil producir la fusión caliente si no es en un deuterio y un nucleo de
tritio.Mediante la fusión fría, dos núcleos
de deuterio son
fácilmente fusibles en helio, e incluso la fusión de los nucleos de hidrógeno.
La producción de neutrones, el trítio, protones y la radiación gamma han sido provocados por la fusión fría.Pero no en la candidad que la fusión estadar
La producción de neutrones, el trítio, protones y la radiación gamma han sido provocados por la fusión fría.Pero no en la candidad que la fusión estadar
SOLIDIFICACIÓN
La solidificación es un proceso que se logra
de modo inverso a la fusión, y que se produce por el enfriamiento de los
líquidos. El punto de fusión que es aquella temperatura por la cual
el sólido pasa al estado líquido, es el mismo punto en
que se produce el proceso inverso de solidificación. En el agua ocurre a 0º C.
Se trata de un proceso físico que
generalmente implica una disminución del volumen del cuerpo, salvo en el agua,
que aumenta su volumen al solidificarse.
Al sustraerse calor al líquido éste irá disminuyendo su
temperatura, las partículas que lo componen tendrán cada vez menos movimiento, hasta que se
ordenan, tomando una posición en la estructura cristalina.
Ese es el momento en que se opera la solidificación, y el líquido perderá su capacidad de fluir.
También puede ocurrir la solidificación de metales, dentro de la
fabricación de productos con esos materiales, para darles forma. Primero el
metal se calienta para pasarlo al estado líquido, y luego se le retira energía para que
solidifique dentro de moldes, y vuelva a su estado sólido original. La
temperatura va a ir disminuyendo en forma uniforme y continua hasta que
comienza la solidificación.
Los metales puros, que requieren una temperatura constante para su
solidificación, pasan por varias etapas antes de solidificarse. La primera es
la nucleación, donde solo se solidifican ciertos puntos específicos, formándose
granos finos. Cuando se amplía esta solidificación formándose dendritas o
cristales, estamos en la etapa de cristalización. Estas dendritas se van ampliando hasta que todo el material se
solidifica, formando los límites de grano en las regiones de encuentro.
En las aleaciones, la
solidificación no ocurre a temperaturas constantes, sino en intervalos de temperaturas.
LA EVAPORARIZACION Y EBULLICIÓN
La vaporización es el nombre que recibe el proceso en el cual un fluido
pasa del estado líquido al gaseoso, es decir, como consecuencia de la acción del calor sobre el
líquido en cuestión es que el líquido asumirá el estado de gaseoso.
Existen dos tipos de vaporización, la ebullición y la evaporación.
La ebullición se producirá cuando el mencionado
cambio de estado se produce por el aumento de la temperatura que se experimenta
en el interior del líquido; cabe destacar, que el momento clave de ebullición
se plantea en la instancia en la que la temperatura ocasiona que cualquier
líquido hierva, y a partir de ella permanecerá constante todo el tiempo que
dure el proceso de ebullición.

Si en una olla a presión colocamos agua y luego la colocamos en el fuego, antes
de que se produzca el hervor, el agua se calentará unos 120° y 130 ° por la
mayor presión que ejercen los gases en su interior. Es como consecuencia de
este aumento de temperatura que la cocción de la comida se produce más rápido.
En tanto, si al agua le agregamos aditivos podremos aumentar o disminuir el
punto de ebullición. Cabe destacar, que el proceso de ebullición ha sido usado
tradicionalmente como el método por excelencia para esterilizar el agua, dado
que la mayoría de los microorganismos mueren indefectiblemente al llegar el
agua al mencionado punto.
Y por su lado la evaporación, se
caracteriza porque el mencionado cambio de estado de líquido a gaseoso se
produce únicamente en la superficie del líquido y a cualquier temperatura,
aunque, el mismo será más rápido cuanto mayor sea la temperatura. Por ejemplo,
al servir una taza de té con agua hervida, es posible ver como el agua se
condensa en pequeñas gotas visibles, también, el vapor de agua al condensarse
se convierte en nubes.
LA PROPAGACIÓN DEL CALOR
es el proceso mediante el cual se intercambia energía en
forma de calor entre distintos cuerpos, o entre
diferentes partes de un mismo cuerpo que tienen diferente temperatura.
Existen tres formas de
propagación del calor que son por: conducción, convección y radiación y que a veces puede producirse en
forma combinada.
1.-Conducción
Esta forma de
propagación se da en los sólidos, cuando se aplica calor a un objeto sólido, la
zona donde absorbe calor se calienta y sus partículas adquieren mayor movilidad
que el resto del cuerpo y cada partícula transmite el calor a las partículas
vecinas, con el cual el calor acaba por propagarse por todo el objeto.
Ejemplos:
- Utensilios
metálicos para cocinar, como por ejemplo una olla de acero. Esta recibe el
calor en la base y luego se propaga por toda la olla. Es por ello que las
asas tienen que ser de un material aislante como madera o plástico, para
no sufrir quemaduras.
- Tenemos
un vaso de leche que está muy caliente. En su interior se introduce una
cuchara. Al pasar un rato, si se toca la cuchara que se encuentra en su
interior, se nota que se va calentando cada vez más. Esta transferencia de
calor se ha producido desde una sustancia, que es la leche, hasta un
cuerpo, que es la cuchara.
2.-Convección
La propagación del calor
por convección se da en los líquidos y en los gases. Es decir cuando calentamos
un líquido o un gas en un recipiente, las primeras partículas en calentarse son
las del fondo, por la que parte del líquido o del gas del fondo se dilata
y disminuye su densidad y al ocurrir esto esta parte del líquido o gas asciende
por el recipiente y la parte del líquido o gas que estaba encima baja
para ocupar el espacio dejado, originándose las llamadas corrientes de
convección que van calentando todas las sustancias del recipiente.
Ejemplos :
- El
aire por convección origina los vientos.
- Si
se coloca una espiral de cartulina, en un soporte universal y se sopla
desde abajo hacia arriba se puede apreciar cómo esta comienza a girar
alrededor del punto donde se apoya. También si se coloca una vela
encendida o cualquier otra fuente de calor debajo del espiral, esta gira
porque el aire que se calienta, asciende y esto se demuestra porque se
pone en movimiento la espiral, igual que cuando se soplaba desde abajo
hacia arriba. Por tanto, se producen corrientes de aire caliente que suben
y de aire frío que baja.
3.-Radiación
La radiación es la
propagación del calor que tiene lugar sin el apoyo del ningún medio material.
Ejemplos:
- Los
radiadores
- Las
aguas del mar reciben la radiación del sol por eso logran evaporarse.
- Los
panaderos, cuando van a sacar el pan del horno, están recibiendo el calor
procedente de este, por radiación.
- Los
obreros metalúrgicos reciben mucho calor procedente de los altos hornos en
que se funden los metales y ese calor les llega por radiación.
- En
sus hogares, cuando mamá está cocinando, recibe por radiación el calor
procedente de la cocina, puesto que no está situada encima de la fuente de
calor, ni en contacto directo con ella, sino delante de las hornillas.
ELEQUIVALENTE MECÁNICO DEL
CALOR.
Históricamente se tardó bastante tiempo en comprender
cuál es la naturaleza del calor. En un primer momento se pensaba que el calor
era un fluido (denominado calórico) que impregnaba los cuerpos y era
responsable del calor que éstos intercambiaban al ser puestos en contacto.
En el siglo XIX, Joule ideó
un experimento para demostrar que el calor no era más que una forma de energía,
y que se podía obtener a partir de la energía mecánica. Dicho experimento se
conoce como experimento
de Joule para
determinar elequivalente mecánico del calor.
Antes del experimento de Joule se pensaba que calor y
energía eran dos magnitudes diferentes, por lo que las unidades en que se
medían ambas eran también distintas. La unidad de calor que se empleaba era la caloría.
|
Una caloría es la cantidad de calor necesaria para elevar la
temperatura de un gramo de agua destilada desde 14.5ºC a 15.5ºC..
|
Con su experimento, Joule se propuso demostrar que se
podía elevar la temperatura del agua transfiriéndole energía mecánica. El
aparato que empleó se muestra en la siguiente figura. En el interior de un
recipiente se introduce 1 kg de agua a 14.5 ºC.
Al recipiente se le acoplan unas paletas conectadas mediante una cuerda con una masa que puede caer. Conforme la masa cae a velocidad constante, las paletas giran, por lo que se convierte la energía potencial gravitatoria de la masa en energía para hacer girar las paletas. Debido a este giro, el agua aumenta de temperatura (el giro de las paletas se transforma en calor).
Lo que encontró Joule fue que, para elevar
la temperatura del kilogramo de agua hasta 15.5ºC (es decir, para conseguir una
energía de 1000 calorías), la energía potencial de la masa debía disminuir en
4180 Julios. Por tanto, la equivalencia entre unidades de calor y energía es:
|
El descubrimiento de Joule llevó a la teoría de la conservación
de la energía lo
que a su vez condujo al desarrollo del primer
principio de la Termodinámica.
|
La primera
ley de la termodinámica establece que la energía no
se crea, ni se destruye, sino que se conserva. Entonces esta ley expresa
que, cuando un sistema es sometido a un ciclo
termodinámico, el calor cedido por el sistema será igual al
trabajo recibido por el mismo, y viceversa.
Es decir Q
= W, en que Q es el calor suministrado por el sistema al medio
ambiente y W el trabajo realizado por el medio ambiente al sistema durante el
ciclo.
Un ejemplo sencillo seria: Al remover
con un taladro el agua contenida en un recipiente, le
estamos aplicando trabajo, que es igual al calor que este emite al medio
ambiente al calentarse. En este caso, el sistema puede ser el agua, el medio
sería el taladro, el aire circundante y todo lo que está fuera del sistema que
no sea agua (pues lo que está afuera recibirá calor del sistema).
La primera ley para un sistema
En este caso, el sistema podría ser el agua contenida en un
recipiente, y el medio ambiente todo lo que rodea el recipiente, que serian
desde la cocina en donde descansa el recipiente con agua hasta el quemador que
le suministra calor, en fin, la atmósfera y todo lo que esté fuera del
recipiente.
Supongamos que encima de este recipiente colocamos una tapa,
únicamente usando su peso. Supongamos además que al recipiente se le suministra
calor del quemador de la cocina que lo contiene. A medida que el agua empieza a
hervir, la tapa
empieza a moverse cada vez más rápidamente. El movimiento de la tapa es
entonces el desplazamiento que representa el trabajo realizado por el sistema
sobre el medio ambiente.
La energía interna
Cuando el agua está hirviendo,
hace que la tapa del recipiente realice el trabajo. Pero esto lo hace a costa
del movimiento molecular, lo que significa que no todo el calor suministrado va
a transformarse en trabajo, sino que parte se convierte en incremento de la energía interna, la cual obedece
a la energía cinética de traslación, vibración y potencial
molecular. Por lo que la fórmula anterior que mencionamos también tendría que
incluir a la energía interna.
Formulación de la primera ley para un sistema
La primera ley expresa que el calor,
suministrado por el medio ambiente (el quemador de la cocina) a un sistema (el
agua contenida en el recipiente) es igual al cambio de la energía internaen
el interior del liquido (agua en este caso) sumada al trabajo que
el agua realiza cuando al hervir mueve la tapa contra el medio ambiente.
Por lo tanto: el calor cedido por el medio al sistema será
igual a la variación de la energía interna en el interior del sistema (agua)
más el trabajo realizado por el sistema sobre el medio.
Signos del calor y el trabajo
Si el medio suministra calor sobre el sistema, el calor será positivo y
si recibe calor del sistema será negativo. Si el
medio realiza trabajo sobre el sistema, el trabjo será negativo y
si recibe trabajo de parte del sistema, el trabajo será positivo.
Ley de conservación
La primera
ley de la termodinámica es
entonces la ley de conservación de la energía,
que asegura que la energía no se crea, ni se destruye, sino que se conserva.
Esta ley ha sido confirmada en numerosos e interminables
experimentos y hasta hoy no ha habido uno solo que la contradiga. Por esto
cuando una persona como Stephen Hawking busca explicar un fenómeno físico, debe
asegurarse de que sus conclusiones no violen la primera ley de la
termodinámica.
No hay comentarios:
Publicar un comentario